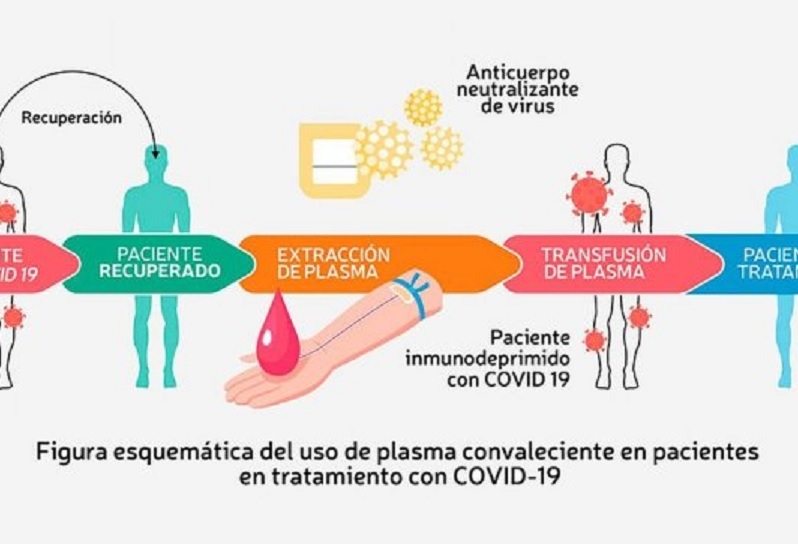
El Plan Estratégico incluye un proyecto de desarrollo de una Inmunoglobulina Hiperinmune a partir del plasma de convalecientes. Esta experiencia será coordinada por la Universidad Nacional de Córdoba, a través de su Laboratorio de Hemoderivados.
Para el desarrollo del plan es indispensable obtener plasma de pacientes recuperados de COVID-19 y procesarlo industrialmente, para dar lugar a la fabricación de un medicamento experimental a partir de las inmunoglobulinas hiperinmunes.
Los pacientes que se han recuperado de la infección por COVID-19 contienen en el plasma de su sangre anticuerpos contra el virus.
Otro eje del Plan Estratégico lanzado por el Ministerio de Salud de Nación es un Proyecto de desarrollo de un Ensayo Clínico Nacional para evaluar la seguridad y eficacia del uso de plasma de convalecientes en enfermos de COVID-19.
Aquellos convalecientes que se encuentran en condiciones de donar serán convocados progresivamente por la Red de Bancos de Sangre públicos y privados de todo el país, para así poder colectar el plasma por medio de un procedimiento denominado aféresis.
En una primera instancia se iniciará la aplicación del Protocolo en la Región del AMBA motivo por el cual se le ha solicitado a los Coordinadores de Hemoterapia de CABA y Provincia de Buenos Aires designen las instituciones que iniciarán este proceso y tramiten ante sus Autoridades Sanitarias la autorización correspondiente.
En una segunda instancia se deberá convocar a las demás Autoridades jurisdiccionales a que designen sus centros oficiales con el fin de sumarse al proyecto y tener una cobertura en todo el país. Se ha solicitado a los Coordinadores de Hemoterapia que inicien gestiones ante sus autoridades para la designación oficial de los centros.
A continuación la Resolución 783/2020
VISTO el EX-2020-26066217- -APN-SCS#MS, el Decreto N° 260 del 12 de marzo de 2020, y CONSIDERANDO Que con fecha 11 de marzo de 2020, la ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS), declaró el brote del nuevo coronavirus COVID-19 como una pandemia. Que por el Decreto N° 260 del 12 de marzo de 2020 se amplió en nuestro país la emergencia pública en materia sanitaria establecida por Ley N° 27.541, por el plazo de UN (1) año en virtud de la pandemia declarada por la ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS) en relación con el coronavirus COVID-19.
Que mediante el artículo 2, inciso 16 del decreto aludido en el considerando precedente se facultó al MINISTERIO DE SALUD, en tanto autoridad de aplicación, a adoptar cualquier otra medida que resulte necesaria a fin de mitigar los efectos de la pandemia declarada por la ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS).
Que la DIRECCIÓN DE MEDICINA TRANSFUSIONAL ha elaborado un ensayo clínico nacional orientado a evaluar la seguridad y eficacia del tratamiento de enfermos de COVID-19 con plasma de convalecientes junto a entidades de reconocida trayectoria en este campo de la salud pública.
Que el Laboratorio de Hemoderivados de la Universidad Nacional de Córdoba, que cuenta con una amplia experiencia y reconocimiento internacional, prevé desarrollar un medicamento a partir del plasma de pacientes recuperados de COVID-19. Que la ADMINISTRACIÓN NACIONAL DE LABORATORIOS E INSTITUTOS DE SALUD “Dr. Carlos G. Malbrán”, a través del Instituto Maiztegui que detenta una histórica experiencia en el tratamiento de la Fiebre Hemorrágica Argentina con plasma, ha propuesto desarrollar la determinación de anticuerpos neutralizantes contra el COVID-19.
Que estos proyectos han tenido la colaboración del Hospital de Pediatría S.A.M.IC. “Prof. Dr. Juan P. Garrahan”; el Instituto de Microbiología y Parasitología Médica de la Universidad de Buenos Aires (U.B.A.); la Asociación Argentina de Hemoterapia, Inmunohematología y Terapia Celular, de la Sociedad Argentina de Infectología; y la Sociedad Argentina de Terapia Intensiva.
Que la SECRETARÍA DE CALIDAD EN SALUD ha tomado intervención observando la conveniencia de integrar todos estos proyectos de investigación en un PLAN ESTRATÉGICO PARA REGULAR EL USO DE PLASMA DE PACIENTES RECUPERADOS DE COVID-19 CON FINES TERAPÉUTICOS, ante el desafío que presenta la pandemia y a los fines de obtener resultados más eficientes.
Que resulta necesario que las autoridades sanitarias jurisdiccionales definan cuáles serán los centros regionales de hemoterapia y/o bancos de sangre intrahospitalarios responsables de realizar la captación y recolección de plasma de los pacientes recuperados de COVID-19 a fin de ejercer un control y seguimiento adecuado del procedimiento.
Que la creación del PLAN ESTRATÉGICO PARA REGULAR EL USO DE PLASMA DE PACIENTES RECUPERADOS DE COVID-19 CON FINES TERAPÉUTICOS no implica erogación presupuestaria alguna para este ministerio. Que la DIRECCIÓN GENERAL DE ASUNTOS JURÍDICOS ha tomado la intervención de su competencia. Que la presente medida se dicta en uso de las facultades conferidas por la Ley de Ministerios Nº 22.520, sus modificatorias y complementarias y por el Decreto Nº 260/2020. Por ello,
EL MINISTRO DE SALUD RESUELVE
Artículo 1°: Créase el PLAN ESTRATÉGICO PARA REGULAR EL USO DE PLASMA DE PACIENTES RECUPERADOS DE COVID-19 CON FINES TERAPÉUTICOS, cuyos lineamientos se encuentran detallados en el Anexo I (IF-2020-26315442-APN-SCS#MS) que forma parte integrante de la presente Resolución, asignando su coordinación a la Secretaría de Calidad en Salud a través de la Dirección de Medicina Transfusional.
Artículo 2°: Requiérese a las autoridades sanitarias jurisdiccionales la definición de los Centros Regionales de Hemoterapia y/o Bancos de Sangre intrahospitalarios que serán los responsables de realizar la captación y recolección de plasma de los pacientes recuperados de COVID-19.
Artículo 3°: Agradécese el valioso aporte por parte de los actores e instituciones que han colaborado en la elaboración del presente Plan Estratégico.
Artículo 4º: Regístrese, comuníquese, publíquese, dése a la DIRECCIÓN NACIONAL DEL REGISTRO OFICIALl y archívese. Ginés Mario González García NOTA: El/los Anexo/s que integra/n este(a) Resolución se publican en la edición web del BORA -www.boletinoficial.gob.are. 18/04/2020 N° 17332/20 v. 18/04/2020
Fecha de publicación 18/04/2020